アカルディカプセル1.25/アカルディカプセル2.5
- **2014年9月改訂(第7版)
- *2010年11月改訂
872119
- 再審査結果公表年月(最新)
- *2010年10月
- 心不全治療薬
販売名アカルディカプセル1.252119006M1029- 承認番号
- 6AMY-243
- 商標名
- Acardi Capsules 1.25
1994年8月
1994年9月
- 貯法
- 気密容器
- 使用期限
- 外箱に使用期限を表示
- **処方箋医薬品注)
- 注)注意−医師等の処方箋により使用すること
- 成分・含量
- 1カプセル中ピモベンダン 1.25mg
- 添加物
- 無水クエン酸、結晶セルロース、軽質無水ケイ酸、ポビドンK25、ステアリン酸マグネシウム
カプセル本体に酸化チタン、黄色三二酸化鉄、ラウリル硫酸ナトリウム、マクロゴール4000、ゼラチンを含有する。
- 剤形
- 黄褐色不透明の硬カプセル剤
- 内容物
- 白色の粉末又は粒状
- 外形
- 3号

- 長さ
- 約16mm
- 直径
- 約6mm
- 重さ
- 約0.20g
- 識別コード
販売名アカルディカプセル2.52119006M2025- 承認番号
- 6AMY-244
- 商標名
- Acardi Capsules 2.5
1994年8月
1994年9月
- 貯法
- 気密容器、遮光保存
- 使用期限
- 外箱に使用期限を表示
- **処方箋医薬品注)
- 注)注意−医師等の処方箋により使用すること
- 成分・含量
- 1カプセル中ピモベンダン 2.5mg
- 添加物
- 無水クエン酸、結晶セルロース、軽質無水ケイ酸、ポビドンK25、ステアリン酸マグネシウム
カプセル本体に酸化チタン、黄色三二酸化鉄、青色1号、ラウリル硫酸ナトリウム、マクロゴール4000、ゼラチンを含有する。
- 剤形
- 頭部緑色不透明、胴部黄褐色不透明の硬カプセル剤
- 内容物
- 白色の粉末又は粒状
- 外形
- 2号

- 長さ
- 約18mm
- 直径
- 約6mm
- 重さ
- 約0.27g
- 識別コード
- ピモベンダン製剤
- 1.
下記の状態で、利尿剤等を投与しても十分な心機能改善が得られない場合- 急性心不全
- 2.
下記の状態で、ジギタリス製剤、利尿剤等の基礎治療剤を投与しても十分な効果が得られない場合- 慢性心不全(軽症〜中等症)
- 急性心不全
- 成人にはピモベンダンとして1回2.5mgを経口投与する。なお、患者の病態に応じ、1日2回経口投与することができる。また、必要に応じて、ジギタリス製剤等と併用する。
- 慢性心不全(軽症〜中等症)
- 通常、成人にはピモベンダンとして1回2.5mgを1日2回食後に経口投与する。なお、年齢、症状により適宜増減する。ただし、ジギタリス製剤、利尿剤等と併用する。
(次の患者には慎重に投与すること)- 1.
- 肥大型閉塞性心筋症、閉塞性弁疾患の患者
- 2.
- 急性心筋梗塞の患者[不整脈があらわれることがある。]
- 3.
- 重篤な不整脈のある患者及び高度の房室ブロックのある患者[不整脈を助長することがある。]
- 4.
- 重篤な脳血管障害のある患者
- 5.
- 重篤な肝・腎障害のある患者
- 1.
- 本剤の投与中は血圧、心拍数、心電図、尿量等、患者の状態を定期的に観察すること。特に心室性期外収縮、心室頻拍等の不整脈が発現した場合には、減量(例えば1回1.25mg)又は休薬するなど適切な処置を行うこと。他の強心剤と併用する場合には、副作用が増強するおそれがあるので低用量(例えば1回1.25mg)から投与開始するなど注意して投与すること。
- 2.
- 腎障害のある患者で本剤と利尿剤を併用する場合には、本剤による循環動態の改善により利尿が促進され、脱水傾向となることがある。そのような場合に腎障害が悪化するおそれがあるので、利尿剤を減量するなど適切な処置を行うこと。
- 3.
- 急性心不全の場合
- (1)
- 心原性ショック状態においては、必要に応じ最初に輸液、輸血、呼吸管理、ステロイド投与等の処置を考慮する。
- (2)
- 上記に準じた処置を施し、経口投与が可能となった時点で本剤を投与すること。
また、必要に応じ、ジギタリス製剤等と併用する。
- 4.
- 慢性心不全の場合
- (1)
- 本剤は開発時に軽症〜中等症の慢性心不全で臨床試験を行っており、重症の慢性心不全には試験を行っていないので、重症の慢性心不全に対する有用性は確立していない。
- (2)
- 慢性心不全においては、ジギタリス製剤、利尿剤等の基礎治療剤で十分な効果が認められていない症例にのみ、本剤を投与すること。なお、本剤の単独投与での有用性は確立していない(使用経験が少ない)。
- (3)
- 慢性心不全患者での長期生命予後に対する本剤の安全性は確立されていない。1)本剤の長期使用にあたっては、患者の症状に応じて低用量(例えば1回1.25mg)から開始するなど適切な処置を行うこと。
- *臨床試験及び市販後の使用成績調査・特別調査での調査症例4,009例中、副作用が報告されたのは319例(7.96%)であった。主な副作用は動悸42件(1.05%)、悪心31件(0.77%)、心室性期外収縮28件(0.70%)、低血圧19件(0.47%)等であった。また、臨床検査値については特に一定の傾向を示す変動は認められていない(再審査終了時)。
- 1.
心室細動(0.1%〜5%未満)- 心室細動があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、直ちに投与を中止し、除細動等の適切な処置を行うこと。
- 2.
心室頻拍(0.1%〜5%未満)、心室性期外収縮(0.1%〜5%未満)- 心室頻拍(torsades de pointesを含む)、心室性期外収縮等の不整脈があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、減量又は休薬するなど適切な処置を行うこと。
- 3.
肝機能障害、黄疸(頻度不明)- AST(GOT)、ALT(GPT)、γ-GTPの上昇等を伴う肝機能障害や黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行うこと。
- 循環器注)
- 0.1〜5%未満
- 心房細動、心房粗動、頻脈、動悸、低血圧
- 循環器注)
- 0.1%未満
- 上室性頻拍、房室ブロック
- 消化器
- 0.1〜5%未満
- 腹痛、食欲不振、悪心・嘔吐、胸やけ
- 精神神経系
- 0.1〜5%未満
- 頭痛、めまい
- 精神神経系
- 0.1%未満
- 頭重感
- 呼吸器
- 0.1%未満
- 咳、喀痰、息苦しさ
- 過敏症注)
- 0.1〜5%未満
- 皮疹
- 腎臓
- 0.1〜5%未満
- 尿酸値、BUNの上昇
- 腎臓
- 0.1%未満
- クレアチニンの上昇
- 血液注)
- 0.1〜5%未満
- 貧血
- 血液注)
- 0.1%未満
- 白血球減少、血小板減少
- その他
- 0.1〜5%未満
- 倦怠感
- その他
- 0.1%未満
- 顔面潮紅、手のむくみ、好酸球の上昇、浮腫
- 以上のような副作用があらわれた場合には、症状に応じて適切な処置を行うこと。
- 注)発現した場合には、減量、休薬又は中止するなど適切な処置を行うこと。
- 一般に高齢者では肝・腎機能が低下していることが多く、また、体重が少ない傾向があるなど副作用が発現しやすいと推定されるので、低用量(例えば1回1.25mg)から投与を開始するなど注意すること。なお、増量する場合は患者の副作用・臨床症状を十分観察しながら行うこと。
- 1.
- 妊婦又は妊娠している可能性のある婦人には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[動物(ラット)で次のことが認められている。]
- (1)
- 妊娠前及び妊娠初期投与試験(経口300mg/kg)で胚死亡率の増加が認めらている。
- (2)
- 周産期及び授乳期投与試験(経口100mg/kg)で出生児体重の低下が認められている。
- 2.
- 本剤投与中は授乳を避けること。[動物(ラット)で乳汁中への移行が認められている。]
- 低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していない。
- 薬剤交付時
- (1)
- PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。(PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。)
- (2)
- 本剤は吸湿性があるので、服用直前にPTPシートから取り出すよう指導すること。また、できるだけPTP包装のまま調剤を行うこと。
- 健康成人並びに急性心不全患者(慢性心不全の急性増悪期を含む)における薬物動態を検討した結果、Cmax及びAUCに個体差が認められた。(【薬物動態】の項参照)
- 1.
吸収・代謝・排泄- 健康成人に本剤5.0mgを経口投与した場合、消化管から速やかに吸収されるが、約34%が初回通過効果を受ける。2)健康成人の主代謝産物(代謝部位:肝臓)はピモベンダンの脱メチル体(活性を有する)及びその抱合体である。3)健康成人に本剤2.5mgを経口投与した場合、未変化体(ピモベンダン)は約0.8時間後に、脱メチル体は約1.3時間後にそれぞれ最高血中濃度(約8.4ng/mL、約3.5ng/mL)に達し、その後それぞれ血中濃度消失半減期(約1時間、約2時間)で減衰する。4)また、健康成人に本剤2.5mg又は5.0mgを1日2回7日間反復経口投与したとき、蓄積性は認められない。5)健康成人に本剤2.5mgを経口投与した場合、尿中へは脱メチル体の非抱合体及び抱合体として排泄され、非抱合体の尿中排泄率(24時間)は投与量の約20〜40%である。4)なお、本剤2.5mgを健康成人に絶食時経口投与した場合、未変化体の最高血中濃度(Cmax)で約6倍、血中濃度曲線下面積(AUC)で約10倍程度の個体差がみられたが、活性代謝物である脱メチル体のCmaxでは約2倍、AUCでは約3倍の個体差であった。6、7)また、本剤2.5mgを急性心不全患者(慢性心不全の急性増悪期を含む)に経口投与した場合、未変化体のCmaxで約5倍、AUCで約7倍の個体差がみられたが、脱メチル体のCmax、AUCではそれぞれ約3倍の個体差であった。8)この個体差は吸収・代謝にばらつきがあるためと考えられる。
[参考:2)は外国人でのデータ] - 2.
分布(参考)- 経口投与した場合、消化管のほかに肝、腎、副腎、肺、心臓、膵臓、脾臓、唾液腺に分布し、脳には分布しなかった(ラット9))。また乳汁中に移行した(ラット9))。
- 急性心不全患者又は慢性心不全患者を対象とした二重盲検比較試験10〜12)を含む臨床試験の結果、本剤の有用性が認められた。これら国内延べ163施設、総計315例について実施された二重盲検比較試験及び一般臨床試験を含む臨床試験の成績は次のとおりであった。
- 投与対象:急性心不全
- 有効例数/効果判定例数:34/52
有効率(有効以上): 65.4% - 投与対象:慢性心不全
- 有効例数/効果判定例数:119/235
有効率(有効以上): 50.6%
- 1.
陽性変力作用- (1)
- 摘出乳頭筋(モルモット13))の収縮力及び単回経口投与(イヌ14))による心筋収縮能(LV-dp/dt max)を用量依存的に増加させた。
- (2)
- 摘出乳頭筋(モルモット15))で、エネルギー効率を変化させることなく収縮力を増強させた。
- (3)
- 慢性心不全モデル(イヌ16))で、心収縮能及び心拡張能を改善した。
- 2.
血管拡張作用- (1)
- KClで収縮させた摘出動脈及び静脈を弛緩させた(ラット17))。
- (2)
- 冠血流量を増加させた(ブタ18))。
- 3.
代謝物の薬理作用- 未変化体(ピモベンダン)は体内に投与された後、肝臓において代謝され脱メチル体となるが、この脱メチル体の陽性変力作用(モルモット13))及びPDE活性抑制作用(モルモット19))は未変化体の34倍及び12.6倍といずれも強い。
- 4.
作用機序- 本剤は、心筋の収縮調節蛋白(トロポニンC)のCa2+に対する感受性増強作用(イヌ20)、イタチ21))とPDE-III活性抑制(モルモット19))を併せ持つことにより陽性変力作用をあらわす。また、PDE-III活性抑制作用により血管拡張作用(ラット17)、ブタ18))をあらわす。
- 5.
臨床薬理- (1)
急性心不全- 1)
血行動態に対する作用- 投与後30分から血行動態が変化し、1.5時間から有意に改善した。22)作用は、投与12時間後も持続していた。23)また、全末しょう血管抵抗及び肺動脈楔入圧を有意に低下させ、心拍出量及び1回拍出量を有意に増加させた。10)
- 2)
カテコールアミンに対する反応性低下の回復- カテコールアミンに対する反応性低下例で反応性が回復し、心拍出量及び1回拍出量が有意に改善した。23)
- (2)
慢性心不全- 1)
心機能、血圧、心拍数に対する作用- 左室収縮末期径の減少及び左室内径短縮率の増大が認められた。なお、収縮期及び拡張期血圧並びに心拍数にはほとんど影響しなかった。11)
- 2)
運動耐容能に対する作用- 心肺運動負荷試験において、AT(Anaerobic Threshold)値を有意に増大させた。24)また、身体活動能力指数を有意に改善した。11、12)
- 一般名
- ピモベンダン(JAN)
Pimobendan(JAN) - 化学名
- (±)-4,5-dihydro-6-[2-(p-methoxyphenyl)-5-benzimidazolyl]-5-methyl-3(2H)-pyridazinone
- 化学構造式
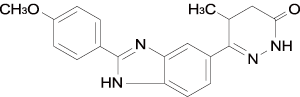
- 分子式
- C19H18N4O2:334.38
- 分子量
- 334.38
- 性状
- ・白色〜微黄色の粉末で、においはない。
・ギ酸又は酢酸(100)に溶けやすく、エタノール(95)にやや溶けにくく、メタノールに溶けにくく、水又はジエチルエーテルにほとんど溶けない。 - 融点
- 約243℃(分解)
- アカルディカプセル1.25:100カプセル(10×10)PTP
- アカルディカプセル2.5:100カプセル(10×10)PTP
- 1)
- PICO Investigators:Heart76:223,1996
- 2)
- Roth W et al:社内資料 健康成人での薬物動態試験
- 3)
- 酒井兼司ほか:社内資料 代謝物の検討試験
- 4)
- 重松昭生ほか:臨牀と研究68:2154,1991
- 5)
- 角尾道夫ほか:臨牀と研究68:3515,1991
- 6)
- 東 純一ほか:基礎と臨床26:1038,1992
- 7)
- 東 純一ほか:基礎と臨床26:1431,1992
- 8)
- 林 博史ほか:Ther Res13:591,1992
- 9)
- 仙田千晶ほか:薬理と治療20:1669,1992
- 10)
- 林 博史ほか:臨床医薬8:813,1992
- 11)
- 加藤和三ほか:臨床医薬8:1311,1992
- 12)
- 篠山重威ほか:臨牀と研究69:1921,1992
- 13)
- Berger C et al:Arzneimittel-Forschung35:1668,1985
- 14)
- van Meel JCA:J Cardiovasc Pharmacol14:(Suppl. 2):S1,1989
- 15)
- Holubarsch C et al:J Cardiovasc Pharmacol14:(Suppl. 2):S13,1989
- 16)
- Asanoi H et al:J Cardiovasc Pharmacol23:268,1994
- 17)
- Fujimoto S and Matsuda T:J Pharmacol Exp Ther252:1304,1990
- 18)
- Verdouw PD et al:Eur J Pharmacol126:21,1986
- 19)
- Brunkhorst D et al:Naunyn-Schmiedeberg's Arch Pharmacol339:575,1989
- 20)
- Fujino K et al:Circulation Research63:911,1988
- 21)
- Lee JA et al:Clinical Science76:609,1989
- 22)
- 亀山智樹ほか:薬理と治療20:1339,1992
- 23)
- Baumann G et al:J Cardiovasc Pharmacol13:730,1989
- 24)
- 谷口興一ほか:臨牀と研究69:1634,1992
主要文献に記載の社内資料につきましても下記にご請求下さい。
日本ベーリンガーインゲルハイム株式会社
DIセンター- 〒141-6017 東京都品川区大崎2丁目1番1号 ThinkPark Tower
- フリーダイヤル:0120-189-779
(受付時間)9:00〜18:00
(土・日・祝日・弊社休業日を除く)
- 製造販売
- 日本ベーリンガーインゲルハイム株式会社
- 東京都品川区大崎2丁目1番1号