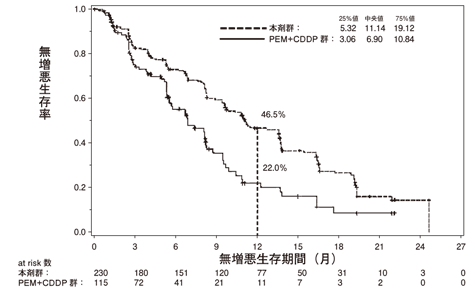
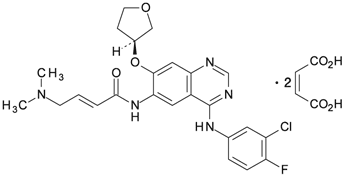
- 1.
- 本剤は、緊急時に十分に対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、添付文書を参照して、適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性(特に、間質性肺疾患の初期症状、服用中の注意事項、死亡に至った症例があること等に関する情報)を十分に説明し、同意を得てから投与すること。
- 2.
- 本剤の投与により間質性肺疾患があらわれ、死亡に至った症例が報告されているので、初期症状(呼吸困難、咳嗽、発熱等)の確認及び定期的な胸部画像検査の実施等、観察を十分に行うこと。異常が認められた場合には投与を中止し、適切な処置を行うこと。また、治療初期は入院又はそれに準ずる管理の下で、間質性肺疾患等の重篤な副作用発現に関する観察を十分に行うこと。
[「慎重投与」、「重要な基本的注意」、「重大な副作用」の項参照]
|