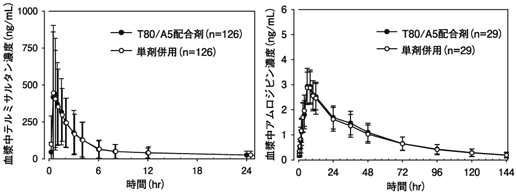
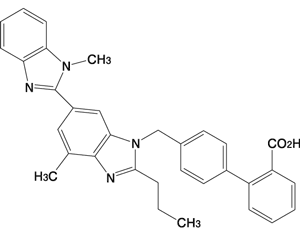
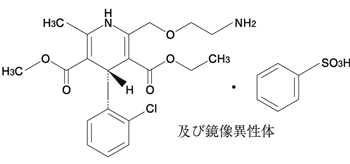
(次の患者には投与しないこと)- 1.
- 本剤の成分及びジヒドロピリジン系化合物に対し過敏症の既往歴のある患者
- 2.
- 妊婦又は妊娠している可能性のある婦人[「妊婦、産婦、授乳婦等への投与」の項参照]
- 3.
- 胆汁の分泌が極めて悪い患者又は重篤な肝障害のある患者[「慎重投与」の項参照]
- 4.
- アリスキレンフマル酸塩を投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)
[非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。(「重要な基本的注意」の項参照)] |