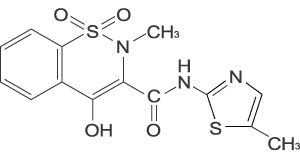
(次の患者には投与しないこと)- 1.
- 消化性潰瘍のある患者[プロスタグランジン合成阻害作用により、胃粘膜防御能が低下し、消化性潰瘍を悪化させるおそれがある(ただし、「慎重投与」2.の項参照)]
- 2.
- 重篤な血液の異常がある患者[血液の異常を悪化させるおそれがある]
- 3.
- 重篤な肝障害のある患者[肝障害を悪化させるおそれがある]
- 4.
- 重篤な腎障害のある患者[プロスタグランジン合成阻害作用により、腎血流量低下及び水、ナトリウムの貯留が起こるため、腎障害を悪化させるおそれがある]
- 5.
- 重篤な心機能不全のある患者[プロスタグランジン合成阻害作用により、腎血流量低下及び水、ナトリウムの貯留が起こるため、心機能不全を悪化させるおそれがある]
- 6.
- 重篤な高血圧症の患者[プロスタグランジン合成阻害作用により、腎血流量低下及び水、ナトリウムの貯留が起こるため、血圧を上昇させるおそれがある]
- 7.
- 本剤の成分、サリチル酸塩(アスピリン等)又は他の非ステロイド性消炎鎮痛剤に対して過敏症の既往歴のある患者
- 8.
- アスピリン喘息(非ステロイド性消炎鎮痛剤等による喘息発作の誘発)又はその既往歴のある患者[重症喘息発作を誘発するおそれがある]
- 9.
- 妊婦又は妊娠している可能性のある婦人(「妊婦、産婦、授乳婦等への投与」の項参照)
|