-
製剤写真・
組成・性状 - お知らせ
- コード・番号表
- FAQ
- 電子添文
- インタビューフォーム
-
くすりのしおり
(日本語) -
くすりのしおり
(英語) - 適正使用ガイド
- RMP
-
患者向
医薬品ガイド - 製造販売後調査
- 患者指導箋
-
その他の
適正使用資料
製剤写真・組成・性状
組成・性状
| 成分名 | リナグリプチン |
|---|---|
| 領域名 | 代謝系疾患 |
| 成分・含量 | 1錠中リナグリプチン 5mg |
| 剤形・色調 | 淡赤色のフィルムコート錠 |
| 外形 |

|
| 識別コード | 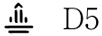 |
| 直径 | 約8mm |
| 厚さ | 約3.5mm |
| 重さ | 約185mg |
剤形

包装形態
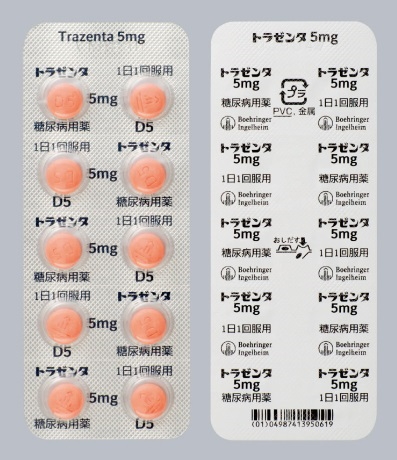
包装変更前
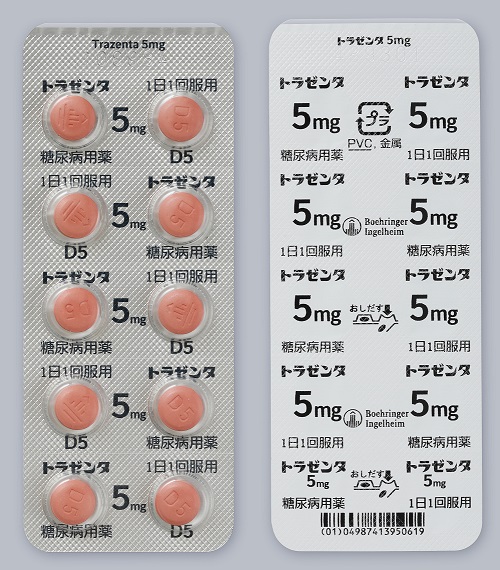
包装変更後
コード・番号表
| 日本標準商品分類番号 | 873969 |
|---|---|
| 承認番号 | 22300AMX00605000 |
| 薬価基準収載 医薬品コード |
3969014F1024 |
| レセプト電算処理コード | 622093501 |
包装:100錠(10錠×10)PTP
| JANコード | 4987413870511 |
|---|---|
| HOT7(処方用番号) | 1209358 |
| HOT番号 | 1209358010101 |
| 販売包装単位コード | (01)14987413870518 |
| 調剤包装単位コード | (01)04987413950619 |
包装:500錠(10錠×50)PTP
| JANコード | 4987413870528 |
|---|---|
| HOT7(処方用番号) | 1209358 |
| HOT番号 | 1209358010102 |
| 販売包装単位コード | (01)14987413870525 |
| 調剤包装単位コード | (01)04987413950619 |
包装:700錠(14錠×50)PTP
| JANコード | 4987413870542 |
|---|---|
| HOT7(処方用番号) | 1209358 |
| HOT番号 | 1209358010201 |
| 販売包装単位コード | (01)14987413870549 |
| 調剤包装単位コード | (01)04987413950633 |
包装:500錠瓶
| JANコード | 4987413870535 |
|---|---|
| HOT7(処方用番号) | 1209358 |
| HOT番号 | 1209358010301 |
| 販売包装単位コード | (01)14987413870532 |
| 調剤包装単位コード | (01)04987413950626 |
よくある質問
-
本剤の電子添文上、手術前後の患者は禁忌となっております。
トラゼンタ錠 電子添文 2. 禁忌(次の患者には投与しないこと)
2.3 重症感染症、手術前後、重篤な外傷のある患者
[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]<参考>
糖尿病患者の代謝調整は、感染を機に急速に悪化し、コントロールが困難になりやすいといわれているため、重症感染症時にはインスリン投与による治療が適応となる。また、手術や重篤な外傷のストレスは、副腎髄質からのアドレナリン分泌を増加し、グリコーゲン及び脂肪の分解が促進され、インスリン分泌が抑制される。更に、視床下部からの刺激により脳下垂体前葉から ACTH(副腎皮質刺激ホルモン)の分泌が生じ、副腎皮質ホルモンの分泌が増加する。これらのコルチゾールは蛋白、アミノ酸からの糖新生を促進し、高血糖を起こす方向に作用するため、手術前後や重篤な外傷のある糖尿病患者は、インスリン注射による血糖管理が適しているため、本剤を投与しない<参考>
トラゼンタ錠 電子添文
トラゼンタ錠 インタビューフォーム Ⅷ.安全性 (使用上の注意等) に関する項目 2.禁忌内容とその理由 -
本剤の簡易懸濁法での投与は承認された用法ではないので、お勧めはできません。
尚、社内試験の結果は55℃の水20mLに対して10分間で崩壊しませんでしたが、粉砕した錠剤を用いて調製した懸濁液はチューブを通過しました。<参考>
試験方法
シリンジに錠剤1個と約55℃の水20mLを入れ、錠剤の崩壊性を調査した。
別に粉砕した錠剤を用いて調製した懸濁液がチューブを通過できるかどうかを評価した。
調製直後及び10分間放置後の懸濁液の含量及びpHを測定した。試験結果
崩壊:10分間で崩壊しなかった
チューブ通過:8Frサイズのチューブを通過した
pH:10分間放置後8.84(懸濁直後8.72)
含量:10分間放置後98.7%(懸濁直後98.9%)<引用>
トラゼンタ錠 インタビューフォーム ⅩⅢ.備 考 1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報その他の関連資料 -
本剤の粉砕投与は承認された用法ではないので、お勧めはできません。
尚、本剤の粉砕品の性状、乾燥減量、含量及び分解物の調査を実施したところ次の通りでした。<参考>
・25°C/60%R.H.下に6ヵ月間保存したとき、すべて規格内であった。
・30°C/75%R.H.下に1ヵ月間保存したとき、吸湿(乾燥減量の増加、規格外)が認められたが、その他の項目は規格内であった。3ヵ月間保存したときには、含量の低下(規格外)が認められた。
・40°C/75%R.H.下に1ヵ月間保存したとき、すべて規格内であった。3ヵ月間保存したときには、含量の低下(規格外)が認められた。
・30°C/92%R.H.下に保存したとき、1週間で吸湿(乾燥減量の増加、規格外)及び含量の低下(規格外)が認められた。
・光照射下(1.2×106 lxꞏh、200W h/m2 以上)では、含量の低下(規格外)が認められた。<引用>
トラゼンタ錠 インタビューフォーム ⅩⅢ.備 考 1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報その他の関連資料 -
本剤の半錠での投与は承認された用量・用法ではないこと、
更に割線がない錠剤であり、投与量の保障ができないことから、お勧めできません。
あいにく弊社では本剤を分割した場合の安定性について検討を行っておりません。 -
本剤の一包化につきましては、次のデータを参考にご判断お願い致します。
<参考>
25℃,60%RH、30℃,75%RH、40℃,75%RHで無包装で6ヵ月保存したところ、乾燥減量が増加しましたが、規格内でした。<引用>
トラゼンタ錠 インタビューフォーム Ⅳ.製剤に関する項目 6.製剤の各種条件下における安定性